Acide éthanique Propriétés physiques, production et utilisation
Acide éthanoïque (également appelé acide acétique)cette substance organique, qui est extrêmement basique, faible, acide carboxylique. Les dérivés de cet acide sont appelés acétates. A l'aide de cette substance, il est possible de produire de l'éther méthylique éthanolique: éthanal + éthanoïque = éther méthylique.
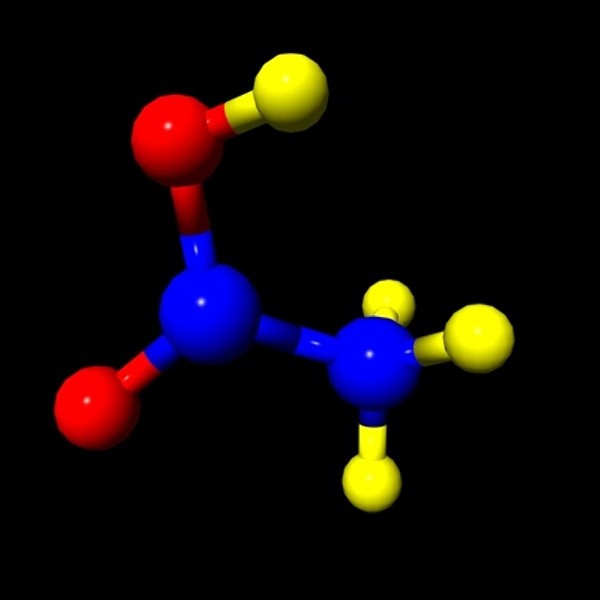
1. L'acide éthanique (formule - CH3COOH) est un liquide sans couleur avec une odeur spécifique et un goût acide désagréable.
2. Il est hygroscopique. Dans l'eau, il est soluble de façon illimitée.
3. L'acide éthanique est mélangé avec la plupart des solvants. Les gaz et composés inorganiques tels que HI (sulfure d'hydrogène), HF (fluorure d'hydrogène), HBr (bromhydrate), HCl (acide chlorhydrique) et beaucoup d'autres sont très solubles dans celui-ci.
4. Il existe sous la forme de dimères linéaires et cycliques.
5. La constante diélectrique est 6.1.
6. La température d'auto-inflammation dans l'air est de 454 degrés.
7. formes acide éthanoïque azéotropes avec du tétrachlorure de carbone, le benzène, le cyclohexane, le toluène, l'heptane, l'éthylbenzène, le trichloroéthylène, l'o-xylène, le p-xylène et bromoforom.

1. En oxydant l'acétaldéhyde avec l'oxygène de l'air. Ce procédé n'est possible qu'en présence d'un catalyseur à l'acétate de manganèse à une température de 50 à 60 degrés. La réaction ressemble à ceci:
2CH3CHO (acétaldéhyde) + O2 (oxygène) = 2CH3COOH (acide éthanoïque)
2. Dans l'industrie, des processus oxydatifs sont utilisés. Auparavant, l'oxydation du butane et de l'acétaldéhyde était utilisée pour produire de l'acide éthanoïque.
L'acétylaldéhyde a été oxydé seulement en présence d'acétate de manganèse à pression et température élevées. En même temps, le rendement en acide éthanique était d'environ quatre vingt quinze pour cent.
2CH3CHO + O2 = 2CH3COOH
Le H-butane a été oxydé à une température de 150 à 200 degrés. Dans ce cas, l'acétate de cobalt a servi de catalyseur.
2C4H10 + 5O2 = 4CH3COOH + 2H2O
Mais à la suite d'une augmentation significative des prix du pétrole, ces deux méthodes sont devenues non rentables et ont rapidement été remplacées par des méthodes plus efficaces de carbonylation du méthanol.
3. La carbonylation du méthanol catalytique est une méthode importante pour la synthèse de l'acide éthanoïque. Se produit selon l'équation conditionnelle:
CH3OH + CO = CH3COOH
4. Il existe également une méthode de production biochimique qui utilise la capacité des microorganismes à oxyder l'éthanol. Ce processus est appelé fermentation acétique. Dans ce cas, la matière première utilisée est un ester aqueux d'alcool éthylique ou de liquides contenant de l'éthanol (jus fermentés). C'est un processus compliqué en plusieurs étapes. Il peut être décrit par l'équation suivante:
CH3CH2OH (éther d'alcool) + O2 (oxygène) = CH3COOH (acide éthanoïque) + H2O

- des solutions aqueuses d'acide éthanique sont utilisées dans l'industrie alimentaire, la cuisine et la mise en conserve;
- L'acide éthane est utilisé pour créer des parfums et des médicaments (acétone, acétylcellulose);
- utilisé dans la teinture et l'impression;
- comme milieu réactionnel pour l'oxydation de certaines substances organiques (oxydation des sulfures par le peroxyde d'hydrogène);
- Puisque les paires d'acide éthanique ont une odeur forte et désagréable, elles peuvent être utilisées à la place de l'ammoniaque.
</ p>