Halogènes: propriétés physiques, propriétés chimiques. L'utilisation d'halogènes et de leurs composés
Halogènes dans le tableau périodique sont situésà gauche des gaz rares. Ces cinq éléments non métalliques toxiques sont inclus dans le groupe 7 du tableau périodique. Ceux-ci comprennent le fluor, le chlore, le brome, l'iode et l'astate. Bien qu'actif soit radioactif et ne possède que des isotopes à vie courte, il se comporte comme l'iode et est souvent considéré comme un halogène. Puisque les éléments halogènes ont sept électrons de valence, ils n'ont besoin que d'un électron supplémentaire pour former un octet entier. Cette caractéristique les rend plus actifs que d'autres groupes de non-métaux.
Caractéristiques générales
Les halogènes forment des molécules diatomiques (de la forme X2, où X est un atome d'halogène) - stableforme d'existence des halogènes sous la forme d'éléments libres. Les liaisons de ces molécules diatomiques sont non polaires, covalentes et uniques. Les propriétés chimiques des halogènes leur permettent de se joindre facilement à la plupart des éléments, de sorte qu'ils ne se produisent jamais non liés dans la nature. Le fluor est l'halogène le plus actif et l'astate est le moins actif.
Tous les halogènes forment des sels du groupe I avec des propriétés similaires. Dans ces composés, les halogènes sont présents sous la forme d'anions halogénures avec une charge de -1 (par exemple, Cl-, Br-). L'identifiant final indique la présence d'anions halogénures; par exemple Cl- est appelé "chlorure".
En outre, les propriétés chimiques des halogènesleur permettre d'agir comme oxydants - oxyder les métaux. La plupart des réactions chimiques dans lesquelles les halogènes sont impliqués sont oxydation-réduction dans une solution aqueuse. Les halogènes forment des liaisons simples avec le carbone ou l'azote dans les composés organiques, où le degré d'oxydation (CO) est de -1. Lorsque l'atome d'halogène est remplacé par un atome d'hydrogène lié de manière covalente dans le composé organique, le préfixe halo peut être utilisé dans un sens général, ou le préfixe fluoro-, chloro-, bromo, iode pour des halogènes spécifiques. Les éléments halogènes peuvent avoir une liaison croisée avec la formation de molécules diatomiques avec des liaisons simples covalentes polaires.
Chlore (Cl2) est devenu le premier halogène découvert en 1774, puis l'iode a été découvert (I2), le brome (Br2), le fluor (F2) et astat (At, a été découvert en dernier, en 1940). Le nom "halogène" vient des racines grecques hal- ("sel") et -gen ("forme"). Ensemble, ces mots signifient «former du sel», soulignant le fait que les halogènes, réagissant avec les métaux, forment des sels. Galite est le nom de sel gemme, un minéral naturel composé de chlorure de sodium (NaCl). Et, enfin, les halogènes sont utilisés dans la vie de tous les jours - on trouve du fluor dans le dentifrice, le chlore désinfecte l'eau potable et l'iode favorise la production d'hormones thyroïdiennes.
Eléments chimiques
Le fluor - un élément avec numéro atomique 9, est désigné parsymbole F. Le fluor élémentaire a été découvert en 1886 en le séparant de l'acide fluorhydrique. A l'état libre, le fluor existe sous la forme d'une molécule diatomique (F2) et est l'halogène le plus commundans la croûte terrestre. Le fluor est l'élément le plus électronégatif du tableau périodique. À température ambiante, il s'agit d'un gaz jaune pâle. Le fluor a également un rayon atomique relativement petit. Son CO-1, à l'exception d'un état diatomique élémentaire, dont le degré d'oxydation est nul. Le fluor est extrêmement actif chimiquement et interagit directement avec tous les éléments à l'exception de l'hélium (He), du néon (Ne) et de l'argon (Ar). Dans une solution de H2O, l'acide fluorhydrique (HF) est faibleacide Bien que le fluor soit fortement électronégatif, son électronégativité ne détermine pas l'acidité; HF est un acide faible dû au fait que l'ion fluor est basique (pH> 7). De plus, le fluor produit des oxydants très puissants. Par exemple, le fluor peut réagir avec un gaz inerte avec du xénon et former un puissant oxydant de difluorure de xénon (XeF).2). Le fluor a de nombreux usages.

Le chlore est un élément avec le numéro atomique 17 et le symbole chimique Cl. Trouvé en 1774 en le séparant de l'acide chlorhydrique. Dans son état élémentaire, il forme une molécule diatomique, Cl2. Le chlore a plusieurs CO: -1, +1, 3, 5 et 7. À température ambiante, il s'agit d'un gaz vert clair. Puisque le lien qui se forme entre les deux atomes de chlore est faible, la molécule Cl2 a une très grande capacité à se joindreconnexion. Le chlore réagit avec les métaux pour former des sels, appelés chlorures. Les ions de chlore sont les ions les plus communs, ils sont contenus dans l'eau de mer. Le chlore a également deux isotopes: 35Cl et 37Cl. Le chlorure de sodium est le composé le plus commun de tous les chlorures.
Le brome est un élément chimique avec le numéro atomique 35 et le symbole Br. Il a été découvert en 1826. Dans sa forme élémentaire, le brome est un Br diatomique2. À température ambiante, il s'agit d'un liquide brun rougeâtre. Son CO est de -1, + 1, 3, 4 et 5. Le brome est plus actif que l'iode, mais moins actif que le chlore. En outre, le brome a deux isotopes: 79Br et 81Vg. Le brome se trouve sous la forme de sels de bromure dissous dans l'eau de mer. Ces dernières années, la production mondiale de bromure a considérablement augmenté en raison de sa disponibilité et de sa longue durée de vie. Comme les autres halogènes, le brome est un agent oxydant et très toxique.
L'iode est un élément chimique avec le numéro atomique 53 et le symbole I. L'iode a des états d'oxydation: -1, +1, +5 et +7. Il existe sous la forme d'une molécule diatomique, je2. À température ambiante, il s'agit d'une substance solide de couleur violette. L'iode a un isotope stable - 127I. Il a été découvert en 1811. à l'aide d'algues et d'acide sulfurique. Actuellement, les ions d'iode peuvent être isolés dans l'eau de mer. Malgré le fait que l'iode ne soit pas très soluble dans l'eau, sa solubilité peut augmenter avec l'utilisation d'iodures individuels. L'iode joue un rôle important dans le corps, participant à la production d'hormones thyroïdiennes.

Astat est un élément radioactif avec un numéro atomique85 et le symbole At. Ses états d'oxydation possibles sont: -1, +1, 3, 5 et 7. Le seul halogène qui ne soit pas une molécule diatomique. Dans des conditions normales, il s'agit d'un solide métallique de couleur noire. Astat est un élément très rare, si peu connu à ce sujet. De plus, l'astate a une demi-vie très courte, pas plus de quelques heures. Obtenu en 1940 à la suite de la synthèse. On pense que l'astate est similaire à l'iode. Il se distingue par ses propriétés métalliques.
Le tableau ci-dessous montre la structure des atomes d'halogène, la structure de la couche externe des électrons.
Halogène | La configuration des électrons |
Fluorure | 1s2 2s2 2p5 |
Chlore | 3s2 3p5 |
Brome | 3d10 4s2 4p5 |
Iode | 4d10 5s2 5p5 |
Astat | 4f14 5d10 6s2 6p5 |
Une structure similaire de la couche externe des électrons fait que les propriétés physiques et chimiques des halogènes sont similaires. En même temps, en comparant ces éléments, des différences sont également observées.
Propriétés périodiques dans le groupe halogène
Les propriétés physiques des substances halogènes simples varient avec l'augmentation du nombre atomique de l'élément. Pour une meilleure compréhension et une plus grande clarté, nous vous proposons plusieurs tables.
Les points de fusion et d'ébullition dans le groupe augmentent avec la croissance de la taille de la molécule (F <Cl <Br <I <At). Cette augmentation signifie une augmentation de la force de Van der Waals.
Tableau 1. Halogènes. Propriétés physiques: point de fusion et point d'ébullition
Halogène | Point de fusion (˚C) | Le point d'ébullition (˚C) |
Fluorure | -220 | -188 |
Chlore | -101 | -35 |
Brome | -7.2 | 58.8 |
Iode | 114 | 184 |
Astat | 302 | 337 |
- Le rayon atomique augmente.
La taille du noyau augmente (F <Cl <Br <I <At),puisque le nombre de protons et de neutrons augmente. De plus, à chaque période, de plus en plus de niveaux d'énergie sont ajoutés. Cela conduit à une plus grande orbitale, et, par conséquent, à une augmentation du rayon de l'atome.
Tableau 2. Halogènes. Propriétés physiques: rayons atomiques
Halogène | Rayon covalent (pm) | Ionique (X-rayon (pm) |
Fluorure | 71 | 133 |
Chlore | 99 | 181 |
Brome | 114 | 196 |
Iode | 133 | 220 |
Astat | 150 |
- L'énergie d'ionisation diminue.
Si les électrons de valence externe ne sont pas localisésprès du noyau, puis de les en retirer ne nécessite pas beaucoup d'énergie. Ainsi, l'énergie nécessaire pour expulser un électron externe n'est pas si élevée dans la partie inférieure du groupe d'éléments, car il y a plus de niveaux d'énergie ici. De plus, l'énergie d'ionisation élevée fait que la cellule présente des qualités non métalliques. L'iode et l'affichage de l'astate présentent des propriétés métalliques, car l'énergie d'ionisation diminue (At <I <Br <Cl <F).
Tableau 3. Halogènes. Propriétés physiques: énergie d'ionisation
Halogène | L'énergie d'ionisation (kJ / mol) |
fluor | 1681 |
chlore | 1251 |
brome | 1140 |
iode | 1008 |
astatine | 890 ± 40 |
- L'électronégativité diminue.
Le nombre d'électrons de valence dans un atome augmente avecaugmentation des niveaux d'énergie à des niveaux progressivement plus bas. Les électrons sont progressivement plus éloignés du noyau; Ainsi, le noyau et les électrons ne sont pas attirés l'un par l'autre. Une augmentation du dépistage est observée. Par conséquent, l'électronégativité diminue avec une période croissante (At <I <Br <Cl <F).
Tableau 4. Halogènes. Propriétés physiques: électronégativité
Halogène | Électronégativité |
fluor | 4.0 |
chlore | 3.0 |
brome | 2.8 |
iode | 2.5 |
astatine | 2.2 |
- L'affinité pour un électron diminue.
Puisque la taille de l'atome augmente avec l'augmentationpériode, l'affinité électronique est habituellement réduite (B <I <Br <F <Cl). L'exception est le fluor, dont l'affinité est inférieure à celle du chlore. Cela peut s'expliquer par la plus petite taille de fluor par rapport au chlore.
Tableau 5. L'affinité des halogènes pour un électron
Halogène | Affinité pour l'électron (kJ / mol) |
fluor | -328.0 |
chlore | -349.0 |
brome | -324.6 |
iode | -295.2 |
astatine | -270.1 |
- La réactivité des éléments diminue.
La réactivité des halogènes diminue avec la croissancepériode (At <I <Br <Cl <F). Ceci est dû à l'augmentation du rayon de l'atome avec des niveaux d'énergie croissants des électrons. Cela réduit l'attraction des électrons de valence des autres atomes, réduisant la réactivité. Cette diminution se produit également en raison de la chute de l'électronégativité avec une période croissante, ce qui réduit également l'attraction des électrons. De plus, à mesure que la taille de l'atome augmente, la capacité oxydante diminue également.

Chimie inorganique. Hydrogène + halogènes
Un halogénure est formé lorsque l'halogène réagit avec un autre élément moins électronégatif pour former un composé binaire. L'hydrogène réagit avec les halogènes pour former des halogénures de type HX:
- le fluorure d'hydrogène HF;
- chlorure d'hydrogène HCl;
- le bromhydrate HBr;
- hydrure d'hydrogène HI.
Les halogénures d'hydrogène se dissolvent facilement dans l'eau avec formation d'un acide halohydrique (hydrofluorique, chlorhydrique, bromhydrique, hydroiodique). Les propriétés de ces acides sont données ci-dessous.
Les acides sont formés par la réaction suivante: HX (aq) + H2O (l) → X- (aq) + H3O+ (aq).
Tous les halogénures d'hydrogène forment des acides forts, à l'exception de HF.
L'acidité des acides halohydriques augmente: HF <HCl <HBr <HI.
L'acide fluorhydrique est capable de graver le verre et certains fluorures inorganiques pendant une longue période.
Il peut sembler illogique que HF soitl'acide halohydrique le plus faible, puisque le fluor a l'électronégativité la plus élevée. Néanmoins, le lien H-F est très fort, à la suite de quoi l'acide est très faible. Une liaison forte est déterminée par la longueur de la liaison courte et l'énergie de dissociation élevée. De tous les halogénures d'hydrogène, HF a la longueur de liaison la plus courte et la plus grande énergie de liaison de dissociation.
Oxoacides halogénés
Les oxoacides halogénés sont des acides avec des atomes d'hydrogène, d'oxygène et d'halogène. Leur acidité peut être déterminée par l'analyse de la structure. Les oxoacides halogénés sont énumérés ci-dessous:
- Acide hypochloreux HOCl.
- Acide chlorique HClO2.
- Acide chlorique HClO3.
- Acide chlorique HClO4.
- Acide hypobutyrique HOBr.
- Acide bromonique HBrO3.
- Acide bromique HBrO4.
- L'acide iodé HOI.
- Acide iodonique HIO3.
- Acide méthionique HIO4, H5IO6.
Dans chacun de ces acides, le proton est lié à l'atomel'oxygène, donc la comparaison des longueurs des liaisons protoniques est inutile ici. Le rôle dominant ici est l'électronégativité. L'activité de l'acide augmente avec le nombre d'atomes d'oxygène liés à l'atome central.
Apparence et condition de la substance
Les principales propriétés physiques des halogènes peuvent être résumées dans le tableau suivant.
L'état de la substance (à température ambiante) | Halogène | Apparence |
solide | iode | violet |
astatine | noir | |
liquide | brome | brun rougeâtre |
gazeux | fluor | brun jaune pâle |
chlore | vert pâle |
Explication de l'apparence
La couleur des halogènes est le résultat de l'absorptionmolécules de lumière visible, ce qui provoque l'excitation des électrons. Le fluor absorbe la lumière violette et, par conséquent, semble jaune pâle. Au contraire, l'iode absorbe la lumière jaune et semble violette (couleurs complémentaires jaune et violet). La couleur des halogènes devient plus sombre à mesure que la période augmente.
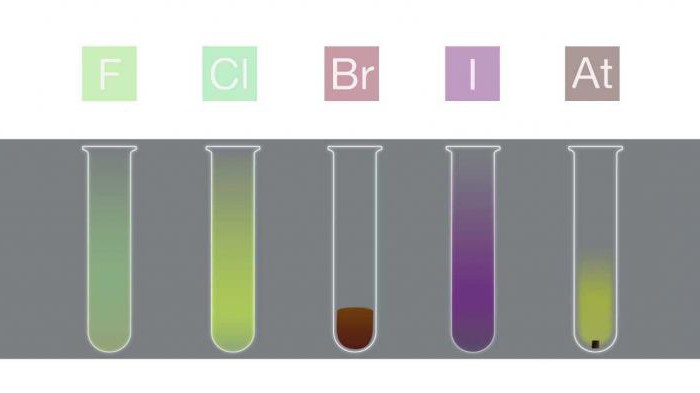
Dans les récipients fermés, le brome liquide et l'iode solide sont en équilibre avec leurs vapeurs, qui peuvent être observées sous la forme d'un gaz coloré.
Bien que la couleur de l'astate soit inconnue, on suppose qu'elle devrait être plus foncée que l'iode (c'est-à-dire noire) en accord avec le motif observé.
Maintenant, si on vous demande: "Caractériser les propriétés physiques des halogènes", vous aurez quelque chose à dire.
Le degré d'oxydation des halogènes dans les composés
Le degré d'oxydation est souvent utilisé à la place dele concept de "valence halogène". En règle générale, le degré d'oxydation est -1. Mais si l'halogène est lié à l'oxygène ou à un autre halogène, il peut prendre d'autres états: le CO-oxygène-2 a la priorité. Dans le cas de deux atomes d'halogène différents réunis, l'atome le plus électronégatif prévaut et prend CO-1.
Par exemple, dans le chlorure d'iode (ICl), le chlore a CO-1 et l'iode +1. Le chlore est plus électronégatif que l'iode, donc son CO est de -1.
Dans l'acide bromique (HBrO4) l'oxygène a CO-8 (-2 x 4 atomes = -8). L'hydrogène a un état d'oxydation total de +1. L'ajout de ces valeurs donne CO-7. Puisque le CO final du composé doit être nul, le CO du brome est de +7.
La troisième exception à la règle est le degré d'oxydation de l'halogène sous forme élémentaire (X2), où son CO est nul.
Halogène | CO dans les composés |
fluor | -1 |
chlore | -1, +1, +3, +5, +7 |
brome | -1, +1, +3, +4, +5 |
iode | -1, +1, +5, +7 |
astatine | -1, +1, +3, +5, +7 |
Pourquoi le CO du fluor est-il toujours -1?
L'électronégativité augmente avec la croissancepériode. Par conséquent, le fluor a l'électronégativité la plus élevée de tous les éléments, ce qui est confirmé par sa position dans le tableau périodique. Sa configuration électronique est 1s2 2s2 2p5. Si le fluor obtient un autre électron, l'extrêmeLes orbitales p sont complètement remplies et constituent un octet entier. Puisque le fluor a une haute électronégativité, il peut facilement prendre un électron d'un atome voisin. Le fluor dans ce cas est isoélectronique à un gaz inerte (avec huit électrons de valence), toutes ses orbitales externes sont remplies. Dans cet état, le fluorure est beaucoup plus stable.
Préparation et utilisation d'halogènes
Dans la nature, les halogènes sont à l'état d'anions,par conséquent, les halogènes libres sont obtenus par oxydation par électrolyse ou au moyen d'agents oxydants. Par exemple, le chlore est produit par hydrolyse d'une solution de sel commun. L'utilisation d'halogènes et de leurs composés est diverse.
- Fluorure. Malgré le fait que le fluor soit très réactif, ilest utilisé dans de nombreux domaines de l'industrie. Par exemple, il s'agit d'un composant clé du polytétrafluoroéthylène (Téflon) et d'autres fluoropolymères. Les chlorofluorocarbures sont des produits chimiques organiques qui servaient auparavant de réfrigérants et de propulseurs dans les aérosols. Leur utilisation a cessé à cause de leur impact possible sur l'environnement. Ils ont été remplacés par des hydrochlorofluorocarbones. Le fluor est ajouté au dentifrice (SnF2) et de l'eau potable (NaF) pour prévenir la carie dentaire. Cet halogène est contenu dans l'argile utilisée pour fabriquer certains types de céramiques (LiF), est utilisé dans l'ingénierie nucléaire (UF6), pour la préparation de l'antibiotique fluoroquinolone, l'aluminium (Na3AlF6), pour l'isolation des équipements à haute tension (SF6).
- Chlore a également trouvé une variété d'applications. Il est utilisé pour la désinfection de l'eau potable et des piscines. L'hypochlorite de sodium (NaClO) est le composant principal de l'eau de Javel. L'acide chlorhydrique est largement utilisé dans l'industrie et les laboratoires. Le chlore est présent dans le chlorure de polyvinyle (PVC) et d'autres polymères qui sont utilisés pour isoler le câblage, les tuyaux et l'électronique. De plus, le chlore était également utile dans l'industrie pharmaceutique. Les médicaments contenant du chlore sont utilisés pour traiter les infections, les allergies et le diabète. La forme neutre du chlorhydrate est un composant de nombreux médicaments. Le chlore est également utilisé pour la stérilisation du matériel hospitalier et la désinfection. Dans l'agriculture, le chlore est un composant de nombreux pesticides commerciaux: le DDT (dichlorodiphényltrichloroéthane) a été utilisé comme insecticide agricole, mais son utilisation a été interrompue.

- Brome, en raison de son incombustibilité, est utilisé poursuppression de la combustion. Il est également présent dans le bromure de méthyle, un pesticide utilisé pour stocker les cultures et inhiber les bactéries. Cependant, l'utilisation excessive de bromure de méthyle a été abandonnée en raison de son impact sur la couche d'ozone. Le brome est utilisé dans la production d'essence, de films photographiques, d'extincteurs, de médicaments pour le traitement de la pneumonie et de la maladie d'Alzheimer.
- Iode joue un rôle important dans le bon fonctionnement deglande thyroïde. Si le corps ne reçoit pas assez d'iode, il y a une augmentation de la glande thyroïde. Pour éviter le goitre, cet halogène est ajouté au sel de table. L'iode est également utilisé comme antiseptique. L'iode se trouve dans les solutions utilisées pour nettoyer les plaies ouvertes, ainsi que dans les sprays désinfectants. En outre, l'iodure d'argent est important en photographie.
- Astat - Halogène radioactif et des terres rares, il n'est donc pas utilisé ailleurs. Néanmoins, on pense que cet élément peut aider l'iode dans la régulation des hormones thyroïdiennes.




