Quelle est la valence de l'oxygène dans les composés?
Afin de déterminer les valeurs possiblesla valence de l'oxygène, nous devrions étudier la position de l'élément dans le tableau périodique, les principales caractéristiques de la structure de son atome. Cette approche est utile dans l'étude de la question de ce que la valence de l'oxygène dans typique et ce n'est pas typique pour lui. Dans les composés les plus communs, la valence habituelle est II. Cette fonction vous permet de définir le nombre d'obligations d'un autre atome dans les formules binaires finis impliquant l'oxygène.
Quelle est la valence de l'oxygène?
Au stade initial de l'accumulation de connaissances surpropriétés et la structure des substances, les chimistes pensaient que la valence est la capacité de lier un certain nombre d'atomes à une molécule de la matière. Beaucoup de scientifiques, après la découverte de l'élément, ont essayé de comprendre quel oxygène est valence. La réponse a été obtenue expérimentalement: l'oxygène ajoute deux atomes d'hydrogène monovalent à la réaction chimique, ce qui signifie qu'il est bivalent. Les représentations du lien chimique ont changé à mesure que les connaissances sur la structure de la matière s'accumulaient. Dans leur théorie de la valence, G. Lewis et V. Kossel révèlent l'essence de l'interaction chimique du point de vue de la structure électronique. Les chercheurs ont expliqué la capacité d'un atome à former un certain nombre de liaisons en recherchant l'état d'énergie le plus stable. Si cela est réalisé, la plus petite particule de la substance devient plus stable. Dans la théorie et les structures de Lewis beaucoup d'attention est accordée au rôle des électrons externes participant à la création d'une liaison chimique.

Caractéristiques du placement de l'oxygène dans le tableau périodique
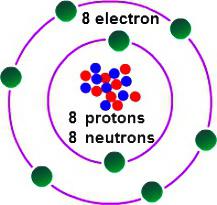
Afin de déterminer quelle valence yl'oxygène, il est nécessaire de prendre en compte certaines caractéristiques de sa structure électronique. L'oxygène mène le 16ème groupe du tableau périodique. Le nom trivial de la famille d'éléments est "chalcogenes", ils sont référés au groupe VI (A) par classification obsolète. Dans le tableau périodique, l'oxygène est dans la cellule sous le n ° 8. Le noyau contient 8 particules élémentaires positives et autant de neutres. Dans l'espace d'un atome, il y a deux niveaux d'énergie qui se produisent lorsque 8 électrons se déplacent, dont 6 sont externes.

Quelle est la relation entre la composition de l'atome et la valence?
Le dernier niveau de l'atome d'oxygène contient 2électrons non appariés. L'élément est inférieur au fluor en termes d'électronégativité (la capacité d'attirer des paires d'électrons se liant à lui-même). Dans la formation de composés avec d'autres éléments, l'oxygène attire sur lui-même la densité électronique totale apparue dans la molécule (sauf pour les électrons de fluor). Atteindre l'état stable de la coque externe est possible avec l'ajout de deux charges négatives. Cela signifie que l'oxygène nécessite 2 électrons. Les options possibles sont les suivantes: prendre un électron (valence II), sélectionner 2 électrons d'un autre atome (valence II), ne pas prendre d'électrons d'autres atomes (valence 0). Le comportement typique de l'oxygène est caractérisé par le second cas. De cette façon, vous pouvez utiliser pour savoir quel oxygène est le plus typique dans ses composés communs. Ceux-ci comprennent la plupart des oxydes de métaux et de non-métaux.
Comment la valence se manifeste-t-elle dans les composés?
Oxygen est capable de directementinteragir avec de nombreux éléments chimiques. On connaît ses composés avec pratiquement tous les représentants du tableau périodique (à l'exception des gaz inertes: argon, hélium, néon). En réaction avec les halogènes, les métaux nobles, l'oxygène ne peut entrer directement, mais les oxydes d'Au2O3, F2O, Cl2O7 et d'autres existent (reçoivent indirectement). Pour les composés binaires dans la formation desquels l'oxygène participe, la liaison covalente et la polarité sont caractéristiques. La valence dans de telles molécules dépend du nombre de paires émergentes d'électrons auxquelles les noyaux d'atomes différents sont attirés. Dans la grande majorité des composés, les atomes d'oxygène participent à la création de deux liaisons covalentes. Par exemple, dans les oxydes de CO2, P2À propos5, SO2, SO3, K2O, B2À propos3, Mo2À propos5 et dans d'autres molécules. Dans le cation hydronium H3O + oxygène présente une valence atypique III. La présence du groupe peroxo -O-O- est due à la nature inhabituelle du peroxyde d'hydrogène H2À propos2. Dans ce composé, l'oxygène présente sa valence inhérente II.
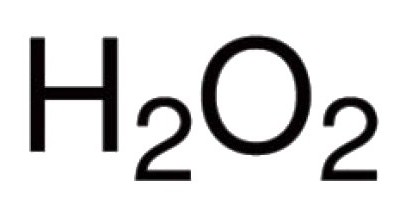
Comment déterminer la valence des éléments?
L'idée des possibilités de valence de l'oxygènedonne la structure de Lewis - le signe chimique de l'élément, autour duquel les électrons marquent la couche externe. Ils sont impliqués dans la création de molécules, font partie des paires électroniques communes. La formule de Lewis démontre clairement la valence de l'oxygène, correspondant au nombre de ses électrons non appariés (2). Le même résultat est fourni par l'utilisation de structures électroniques graphiques. Dans deux cellules du niveau d'énergie externe de l'oxygène, les électrons non appariés sont localisés (indiqués par des flèches dans la formule). L'information sur la valence de l'oxygène permet de déterminer la valeur des atomes voisins à partir de la formule du composé binaire fini. A cet effet, des calculs simples sont effectués. Premièrement, le nombre d'atomes d'oxygène est multiplié par l'exposant de l'oxygène de valence habituel. La valeur résultante doit être divisée par l'indice, qui est indiqué dans la formule à côté du symbole chimique d'un autre élément conjointement avec l'oxygène. En utilisant une méthode simple, nous calculons la valence du carbone et du phosphore dans leurs oxydes.
- Nous multiplions l'indice à droite en dessous du signe de O dans le dioxyde de CO2 à la valence typique de l'élément: 2 • 2 = 4. Le nombre résultant est divisé par l'indice indiqué pour le carbone: 4/1 = 4. Dans le dioxyde de CO2 le carbone est dans son état de valence le plus élevé IV.
- L'indice en bas à droite du symbole chimique de l'oxygène dans l'oxyde de phosphore P2À propos5 multiplier par la valence typique de l'atome O: 5 • 2 = 10. Nous divisons ce nombre par l'indice à droite dans la formule ci-dessous de l'atome de phosphore: 10/2 = 5. Dans l'oxyde, le phosphore est dans son état de valence supérieur V.




