Les isomères structurels sont ce
Dans cet article, nous allons parler des isomères structuraux, des caractéristiques de leur structure et des types d'isomérie. Examinons en détail le phénomène même de l'isomérie, et nous donnerons aussi des exemples de leur utilisation dans la vie.
Le phénomène de l'isomérie
L'isomérie est un phénomène spécial qui prédéterminel'existence de chem. composés, mêmes isomères, substances ayant des compositions identiques d'atomes et de masses moléculaires qui ne diffèrent que par l'arrangement atomique dans l'espace ou dans leur structure, ce qui conduit à un changement et à l'acquisition de propriétés nouvelles et variées. Les isomères structurels sont des substances formées à la suite d'un tel changement dans la position de leurs atomes dans l'espace, qui seront discutés plus en détail ci-dessous.
Parlant de l'isomérie, il convient de rappeler l'existence d'un processus tel que l'isomérisation, qui est le processus de transition d'un isomère à un autre à la suite de la chimie. transformations.
Types d'isomérie
L'isomérie de la valence est une sorte de structure isomère dans laquelle le transfert des isomères eux-mêmes (l'un dans l'autre) est possible à la suite de la redistribution des liaisons de valence.
L'isomérie de position est un type de substance avec un squelette carboné identique, mais une position différente des groupes fonctionnels. Les acides 2- et 4 du chlorobutane en sont un exemple frappant.
L'isomérie interclasse cache sa différence entre les isomères dans la nature des groupes fonctionnels.
Le métamérisme est la distribution de la position des atomescarbone entre un certain nombre de radicaux carbonés, l'hétéroatome de la molécule sert de séparateur. Ce type d'isomérie est caractéristique des amines, des thiospheres, des éthers, à la fois simples et complexes.
L'isomérie du squelette carboné est une différencepositions des atomes de carbone, ou plutôt leur ordre. Par exemple: le phénanthrène et l'anthracène ont la formule générale C14H10, mais différents types de redistribution des liaisons de valence.
Isomères structurels
Les isomères structurels sont des substances ayantune formule similaire pour la structure de la matière, mais diffèrent selon la formule de la molécule. Les isomères structurels - un type de substances qui sont identiques en termes de composition quantitative et qualitative, mais l'ordre de liaison atomique (structure chimique) est différent.
Les isomères structuraux sont classés selon le type de structure isométrique, dont les types sont donnés ci-dessus, dans l'item sur les types d'isomérie.
La formule développée de la substance isomère aune large gamme de modifications. Quelques exemples de isomérie peuvent être des substances telles que l'acide butanoïque, l'acide 2-méthylpropanoïque, le propionate de méthyle, le dioxane, l'acétate d'éthyle, le formiate d'isopropyle ont une composition identique de tous les trois types d'atomes sont constitués de substances, mais qui diffèrent par la position des atomes dans le composé.

Un autre exemple brillant d'isomérie est l'existence du pentane, du néopentane et de l'isopentane.

Noms d'isomères
Comme mentionné précédemment, les isomères structurels sontsubstances qui ont une formule similaire pour la structure de la matière, mais diffèrent selon la formule de la molécule. Ces composés ont une classification qui correspond aux caractéristiques de leurs propriétés, la structure et la position des atomes dans la molécule de l'isomère, les différences dans le nombre de groupes fonctionnels, les liaisons de valence, la présence d'atomes d'un certain élément dans la substance, etc. Les noms des isomères structurels sont obtenus de diverses manières. Considérons ceci pour l'exemple du 3-méthylbutanol 1, en tant que représentant des alcools.
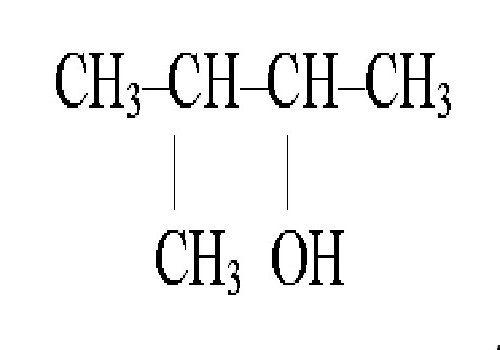
Dans le cas des alcools, quand un nom est obtenules alcools commencent tous par le choix de la chaîne carbonée, qui est la dominante, la numérotation, dont le but est d'attribuer le plus petit nombre possible au groupe OH, en tenant compte de l'ordre. Le nom lui-même commence à être composé d'un substituant dans la chaîne carbonée, suivi du nom de la chaîne principale, suivi du suffixe -ol, et la figure indique l'atome de carbone associé au groupe OH.
</ p>

